
19/04/2024
Con el objetivo de apoyarse mutuamente en temas de interés común, la Vicerrectoría de Extensión y Comunicaciones de la...
16/04/2024
La Comisión Chilena de Energía Nuclear (CCHEN) celebra un hito trascendental en su historia al conmemorar su 60° Aniversario...
01/04/2024
¿Sabías que la aplicación de bajas dosis de radiación ionizante puede estimular la fase de germinación y crecimiento inicial...
27/03/2024
Para trabajar, de manera conjunta y colaborativa, en planes de trabajo, que permitan fortalecer la cooperación y la transferencia...

Nuestra visión es ser reconocidos a nivel nacional e internacional como un referente público en la investigación, desarrollo, regulación y uso pacífico de aplicaciones nucleares
Salud de las Personas
Sostenibilidad y Alimentos
Minería e Industria
Litio y Energía
Nucleoelectricidad
Seguridad y Metrología

![]()
Te invitamos a revisar las sesiones plenarias del 2° Simposio Internacional sobre Protección Radiológica en Medicina.
![]()
Revisa las oportunidades de empleo que ofrece el OIEA aquí
![]()
El OIEA invita a los interesados/as a postular a diversas actividades, que incluyen simposios, conferencias y cursos, entre otros.
Consultas: maria.torres@cchen.cl
![]()
Nueva "Guía para la gestión médica de personas internamente contaminadas con radionúclidos en una emergencia nuclear o radiológica".

La CCHEN cumple el rol de generar productos y ofrecer servicios en diversos ámbitos que afectan la vida diaria de las personas.
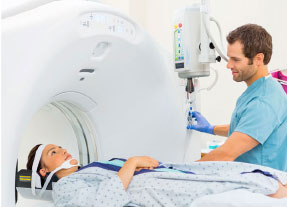
La CCHEN produce isótopos radiactivos, usado para diagnóstico y tratamientos de distintos tipos de cáncer.

En agricultura las técnicas nucleares se emplean en fertilidad de suelos, eficiencia de nutrientes y racionalización del agua.

La CCHEN es un actor fundamental en la esterilización y conservación de alimentos, también en control de plagas.

La CCHEN ofrece servicios de calibración de equipos medidores de radiaciones ionizantes para la salud y la industria.
Hospitales y clínicas a lo largo de Chile utilizaron radioisótopos y radiofármacos producidos en la CCHEN.
Pacientes tratados con insumos generados en la CCHEN para medicina nuclear.
Toneladas de alimentos e insumos esterilizados para su conservación e inocuidad con tecnología nuclear.
Funciona la red de Monitoreo Radiológico Ambiental que otorga la línea de radiación base, ubicado en 9 estaciones de Arica a Puerto Montt.


CCHEN y Tratado de Prohibición Completa de Ensayos Nucleares, CTBT-O
Gestión de Desechos Radioactivos
La CCHEN dicta las normas sobre las medidas de seguridad nuclear y radiológicas requeridas
Vigilancia Radiológica Ambiental
Metrología de Radiaciones Ionizantes
Disminución de carga bacteriana para exportación de alimentos y soluciones de inocuidad
Centro Colaborativo NUCOLAB
Espacio de Co-work donde encontrarás asesoría técnica y profesional especializada
